近年のFDAガイドラインでは、マスターセルバンク作製を含む新規の細胞構築および遺伝子工学に関する研究や臨床試験を可能にするINDに先立ち、GMP試薬の使用を推奨しています。潜在的な規制のリスクを避けるため、各フェーズに適したGMP試薬を調達し、IND申請と合わせて詳細な製造文書を提出する必要があります。
HOME


2022年開設のcGMP製造施設
cGMP製造環境
クラスCバックグラウンド、クラスAアイソレーターを備えたクリーンルーム
無菌ろ過および無菌充填
プロセス開発と最適化
重要品質特性(CQA)/重要工程パラメータ(CPP)確認済み
30 mg – 1gまでの、フレキシブルな製造バッチスケール

製造概要レポート、TSE/BSEステートメント
マスターバッチレコードに基づく製造記録、および変更管理システム
同一性、純度、無菌性などの明確な定義
cGMP準拠材料およびサプライヤー管理
検証済みのQC試験手順
様々な溶液および保存条件下での長期安定性試験
トレーニング、プロセス逸脱およびCAPAなどのQMSの確立
| RUO | GMP-like | cGMP | |
|---|---|---|---|
| Quantity | µg - mg | mg - g | mg - g |
| Purification & Analysis | Desalt or HPLC 90% | NGS | Full Report |
| Analytical Methods | Suitably Verified | Qualified | Validated |
| Documentation | COA | Customizable | Full GMP |
| Facility | Controlled, Unclassified | Classified upon request | Grade C+A (Isolator), capable of sterile product |
| Materials | Traceable with vendor management | Traceable with vendor management | Traceable with vendor management + ID testing |
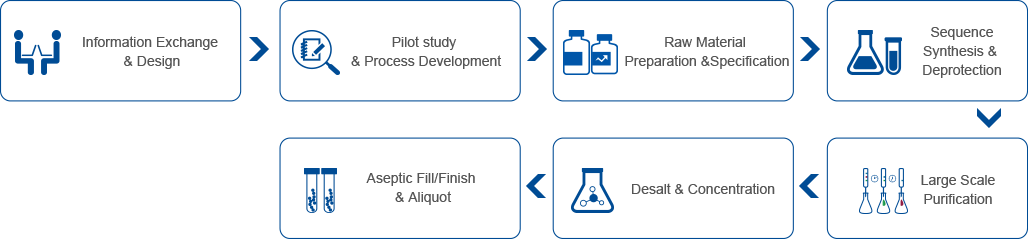
ジェンスクリプトは、研究の初期段階から臨床応用まで、お客様の非ウイルス遺伝子工学および細胞工学の研究開発をサポートするために、知識、能力、経験を兼ねそろえた専門部門と検証済みの製造プロセスを提供しています。当社の包括的ななCRISPR遺伝子編集ソリューションは、お客様の研究開発プロジェクトのあらゆる段階をサポートいたします。
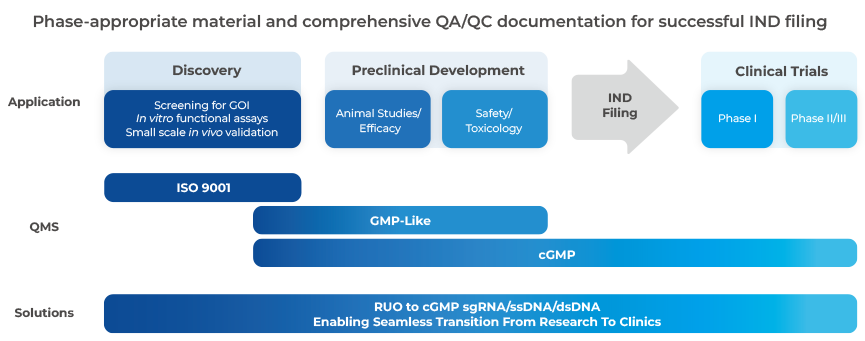
ジェンスクリプトはお客様と連携し、CRISPR遺伝子編集材料の製造およびIND申請や臨床試験に必要な文書の信頼のあるサプライヤーとして貢献します。
近年のFDAガイドラインでは、マスターセルバンク作製を含む新規の細胞構築および遺伝子工学に関する研究や臨床試験を可能にするINDに先立ち、GMP試薬の使用を推奨しています。潜在的な規制のリスクを避けるため、各フェーズに適したGMP試薬を調達し、IND申請と合わせて詳細な製造文書を提出する必要があります。
他のサプライヤーとは異なり、ジェンスクリプトはお客様のGMP合成プロジェクトを滞りなく開始できるキャパシティーがあります。製造タイムラインやお客様のプロジェクトの進捗についてお気軽にjapanmarket@genscript.comまたは担当営業にお問合せください。

